Оригинал: Oncology 2013;84(suppl 1):3–12
DOI: 10.1159/000345883
Перевод статьи выполнен в ООО “Рус-эксп”
- официальный дистрибьютор FUJIFILM (HITACHI) в РФ.
АННОТАЦИЯ
Установлено, что длительная инфекция хронического гепатита С приводит к увеличению риска развития фиброза печени и гепатоцеллюлярной карциномы. В настоящее время гистологический диагноз путем инвазивной и болезненной биопсии печени является золотым стандартом для оценки стадии фиброза печени. Из-за побочных эффектов или неспособности пациента справиться с болью, часто бывает трудно оценивать стадию фиброза с использованием биопсии печени. В последнее время было опубликовано много статей, в которых показана польза ультразвуковой эластографии для оценки стадий фиброза печени без применения биопсии. Мы сообщали о пользе компрессионной эластографии (Real Time Tissue Elastography, RTE) для диагностики стадий фиброза печени в 2007 году. Однако в нашем предыдущем отчете классификация фиброза выполнялась вручную, а количество вовлеченных в исследование пациентов было небольшим. В текущем исследовании процесс определения стадии фиброза выполняется автоматически на основании характера эластограммы. Мы также увеличили число пациентов с 64 до 310. Таким образом, целью этого исследования является увеличение объективности с использованием недавно разработанного метода автоматического анализа. Мы получаем индекс фиброза печени (LFI, или LF Index), который рассчитывается из характеристик изображения компрессионной эластографии (RTE), используя множественный регрессионный анализ, выполненный на клинических данных 310 пациентов в качестве исходных данных. Коэффициент корреляции, полученный между LFI и стадией фиброза печени составил r = 0.68 и существуют значительные различия между всеми стадиями фиброза (p < 0.001). Наш новый метод кажется многообещающим, поскольку он обладает способностью диагностировать фиброз даже при наличии воспаления.
ВВЕДЕНИЕ
По оценкам, ежегодно около 700 000 человек умирают от гепатоцеллюлярной карциномы (ГЦК), что является третьей причиной по количеству смерти от рака [1][2]. ГЦК часто развивается при наличии фиброза в печени от долгосрочного заражения хроническим гепатитом В и С. Сообщается, что риск развития ГЦК возрастает по мере развития фиброза печени [3]. Было показано, что лечение с использованием интерферона уменьшает фиброз печени, а также значительно снижает частоту ГЦК [4]. Таким образом, важно оценить стадию фиброза печения как для планирования лечения, так и для мониторинга его эффективности.
Гистологическая диагностика с использованием биопсии печени очень важна для оценки фиброза печени [5-10]. Однако, из-за инвазивности, биопсия печени не может выполняться часто. Кроме того, в биопсии печени может быть ошибка выборки материала [11-13]. Таким образом, для оценки стадии фиброза печени требуется разработка неинвазивных тесто, которые являются надежными, экономичными и простыми в использовании. Ранее, измерение количества тромбоцитов [14] и маркеров фиброза печени [15-18] применялись в качестве неинвазивных тестов для оценки фиброза печени, но, как правило, основная процедура оценки стадии фиброза печени состоит в том, чтобы объединить использование этих тестов с диагностическими методами визуализациями, такими как УЗИ.
Ультразвуковая визуализация – наиболее полезная диагностическая методика визуализации, используемая для оценки хронического гепатита и/или цирроза. Особенности ультразвукового изображения при оценки фиброза/цирроза печени – узловатая паренхима печени, гетерогенная внутренняя эхо-текстура, уменьшение объема правой печеночной доли и увеличение объёма каудальной и левой печеночной доли, сужение печеночной вены [19, 20]. Тем не менее, при постановки диагноза фиброза печени, такой метод не является надежным, поскольку визуализация может быть изменена из-за различной акустической мощности ультразвук и/или настройками визуализации на оборудовании. В литературе описаны попытки количественного анализа ткани путем анализа сигналов, полученных с УЗИ аппарата, например интенсивности радиочастотных сигналов, степени рассеивания [21, 22] и скорости генерируемой сдвиговой волны в печени [23].
Появляются новые методики оценки жесткости тканей печени или фиброза с использованием ультразвуковой эластографии или МРТ [24]. Существует много типов эластографии, которые популярны, а именно транзиентная эластографии (FibrosScan, зарегистрированная торговая марка Echosens) [25-28], акустическая импульсно-волновая эластография (ARFI) и наша собственная эластография в реальном времени (RTE) [29-32]. FibroScan и ARFI измеряют скорость распространения сдвиговых волн в ткани для измерения жесткости тканей печени, которая затем коррелирует с фиброзом. Однако в случае FibroScan’а измеренная жесткость тканей печени коррелирует не только со стадией фиброза печени, но также и со степенью воспаления. Поэтому влияние многих динамических факторов, не зависящих от фиброза печени (таких как воспаление или холестаз) влияет на получаемую величину измерения. Стадию фиброза печени должен характеризовать параметр, зависящий только от фиброза печени, которая является истинной патологией и не должен включать прочие динамические факторы.
Наша методика компрессионной эластографии RTE (FUJIFILM (HITACHI)) отличается от Fibroscan и ARFI, т.к. она измеряет относительную жесткость ткани в области интереса (ROI) и отображает жесткость цветом, наложенным на В-изображение в режиме реального времени. Помимо визуализации печени, у RTE есть много других клинических применений, которые описаны в литературе, такие как молочная железа, щитовидная железа, предстательная железа и поджелудочная железа [33-36]. Изображение RTE строится с использованием сжатия ткани, которое рассчитывается на двух последовательных кадрах. Разность фаз радиочастотных сигналов из двух последовательных кадров рассчитывается для получения деформации ткани и формирования цветового кодирования. Цвета в области интереса варьируются от синего до красного, чтобы показать относительную жесткость и мягкость тканей в области интереса [30, 31]. Более жесткие области отображаются синим цветом, а более мягкие – красным.
В нашей предыдущей работе с использованием компрессионной эластографией RTE для визуализации печени, мы установили полезность RTE для оценки фиброза печени у пациентов с хроническим гепатитом С. Показатели эластичности печени, которые были оценены визуально, показали значительную корреляцию с фиброзом печени [37]. Компрессионная эластография RTE, доступный как основной режим в ультразвуковых системах FUJIFILM (HITACHI), может применяться для оценки пациентов даже при асците и тяжелой атрофии печени.
Несмотря на то, что наш предыдущий отчет показал применимость компрессионной эластографии RTE, основное ограничение заключалось в том, что оценка эластограмм выполнялась визуально. При визуальной оценке, два радиолога в качестве критерия фиброза печени выбирали увеличение площади синего цвета в эластограмме. Синие области эластограммы RTE увеличивались и становились пятнистыми, поскольку фиброз печени прогрессировал. Но было трудно визуально оценить стадию фиброза печени, поскольку оценка зависела от субъективного мнения каждого радиолога. Кроме того, в нашем прошлом докладе мы не проводили никаких исследований относительно взаимосвязи между степенью воспаления и получаемыми эластограммами RTE.
Таким образом целью данного исследования является:
1)
Представить недавно разработанный программный метод анализа изображений для автоматической оценки индекса фиброза печени (Liver Fibrosis Index, LF Index, LFI) на основании изображений компрессионной эластографии RTE с применением множественного регрессионного анализа [38-40]
2) Показать эффективность этого программного инструмента
3) Обосновать взаимосвязь между индексом фиброза LF Index, стадиями фиброза и степенью воспаления.
ПАЦИЕНТЫ И МЕТОДЫ
Пациенты.
Протокол был создан, следуя Хельсинской декларации и одобрен независимым комитетом по этике 3-х учреждений. Для этого исследования мы выбрали 295 пациентов с хроническим гепатитом С или циррозом. 55 пациентов были исключены из исследования (Таблица 1). Все эти пациенты имели антитела к гепатиту С, РНК позитивные и были продиагностированы с помощью биопсии печени в период с мая 2005 года по декабрь 2009 года. В число пациентов входили 130 мужчин и 165 женщин в возрасте от 26 до 76 лет (средний возраст 56 лет, Таблица 1). 15 здоровых добровольцев были также зарегистрированы как нормальная контрольная группа. Мы получили письменное информаированное согласие всех участников в National Hospital Organization Minamiwakayama Medical Center, Kaizuka City Hospital и Kinki University Hospital (Япония).
Гистология печени.
Биопсия печени выполнялась дважды с использованием автоматической режущей биопсии 18G иглой для биопсии (Adjustable Temno Biopsy System; Cardinal Health, Waukegan, III., USA) под местной анестезией для всех пациентов. Независимо от доброкачественности или злокачественности опухоли, пациенты с опухолью в плоскости изображения от правого межреберья, были исключены из исследования. Длина образцов составляла 20 мм (диапазон 10-25 мм), участки окрашивали гематоксилином и эозином, и трихром по Массону. Эти образцы были исследованы тремя лаборантами для постановки диагноза фиброза, а также для оценки активности. Все три лаборанта не имели любых других клинических данных, включая RTE. Фиброз печени был оценен по шкале от F0 до F4:
F0 – отсутствие фиброза
F1 – портальный фиброз без септ
F2 – портальный фиброз с редкими септами
F3 – многочисленные септы без цирроза
F4 – цирроз
Степени воспалительной активности были классифицированы по шкале от А0 до А3:
A0 – нет активности
А1 – умеренная активность
A2 – средняя активность
А3 – высокая активность
15 здоровых добровольцев были мужчинами в возрасте от 22 до 52 лет (в среднем 31,5), индекс массы тела от 17.9 до 24.7 (в среднем 21.0). Их анализы крови, такие как как аспартатаминотрансзаминаза, аланиновая трансаминаза, гамма-ГТФ, общий холестерин и
триглицериды были в нормальных пределах. У всех добровольцев не было признаков жировой печени по результатам ультразвукового исследования, поэтому биопсия печени не проводилась. Эти пациенты отмечены как F0.

Компрессионная эластография RTE.
Для ультразвуковой диагностики использовался аппараты FUJIFILM (HITACHI) HI VISION 900 (Токио, Япония) с линейным датчиком EUP-L52 (3-7 МГц, 38 мм). Мы использовали линейные датчики для этого исследования, т.к. линейные датчики имеют много преимуществ, когда внутренняя компрессия и расслабление формируется сокращением сердца для получения эластограммы (примечание переводчика: в настоящее время применяют конвексные датчики на более современных аппаратах типа FUJIFILM (HITACHI)AriettaV70 / 850 как более эффективные, о чем сообщено в более новых исследованиях, где также показана высокая корреляция индекса фиброза печени LFIndex при использовании конвексными и линейными датчиками). Мы использовали внутреннее сжатие и расслабление, вызванные сокращениями сердца вместо ручного сжатия (вибрирования датчиком), т.к. это более последовательно и надежно. Хотя поле зрения линейного датчика мало, направление волн сократимости от сердца можно получить на поверхности датчика, что делает его пригодным для анализа компрессионных эластограмм.
После получения изображения в В-режиме, аппарат переключили в режим компрессионной эластографии RTE и сканировали с правого межреберья к правой доле печени. Эластограммы были получены путем удержания датчика в положении, в котором смещение от сокращений сердца в В-режиме было вдоль плоскости датчика. Оптимальным местом межреберья было то, где паренхима печени визуализировалась в наиболее глубокой зоне. В случае, когда печень не была заражена, эластограммы были получены легко сканированием через межреберье от передней к средней подмышечной линии. Поскольку компрессионные эластограммы RTE формируются из значений деформации (strain) вычисленных по смещению вдоль плоскости датчика, положение, при котором паренхима печение перемещается в поперечном (латеральном) направлении сердечного сокращения, не подходит для этого исследования.
Область интереса ROI для компрессионной эластографии RTE была установлена внутри паренхимы печени. Области с крупными сосудами или зоны, имеющие тени от ребер, были удалены из области интереса, чтобы уменьшить артефакты, возникающие от неэхогенных областей. Верхняя часть области интереса была расположена на глубине более 1 см от поверхности печени, чтобы избежать влияния множественных отражений от поверхности печени.
Компрессионную эластографию RTE проводили с использованием метода свободной руки, при этом линейный датчик помещался в соответствующее положение, когда пациент задерживал дыхание. Как упоминалось в предыдущем абзаце, ручное сжатие/расслабление не применялись. Сжатие/расслабление печени, вызванное сердечными сокращениями, легко обнаруживается для формирования изображения деформации. Для оптимального качества эластограмм были заданы параметры ультразвуковой системы, такие как глубина, область интереса (ROI) и коэффициент усиления. Изображения, полученные от поперечных сокращений сердца избегались. От одного до двух эластограмм отображаются за одно сердцебиение и для окончательного анализа было выбрано наилучшая эластограмма (эластографическое изображение RTE). В общей сложности 3-5 эластограмм, полученных из разных сердечных циклов без поперечного движения. Среднее значение этих 3-5 эластограмм для каждого пациента затем использовались в регрессионном анализе.
Мы выделили следующие 9 характеристик изображения для количественной оценки эластограмм. Более подробно об этих характеристиках можно найти в литературе [41]. Все 9 характеристик были обозначены в литературе как очень полезные особенности изображения для многих приложений, таких как например, обработка спутниковых снимков, геотермальные изображения или машинное зрение [42]. Для оценки фиброзов печени с использованием компрессионной эластографии RTE мы использовали эти особенности изображений для корреляции со стадиями фиброза печени. Анализ этих характеристик изображения эластографии было выполнено с помощью программного обеспечения для прототипирования (Рисунок 1).
Рисунок 1. Стадии анализа эластограммы RTE .
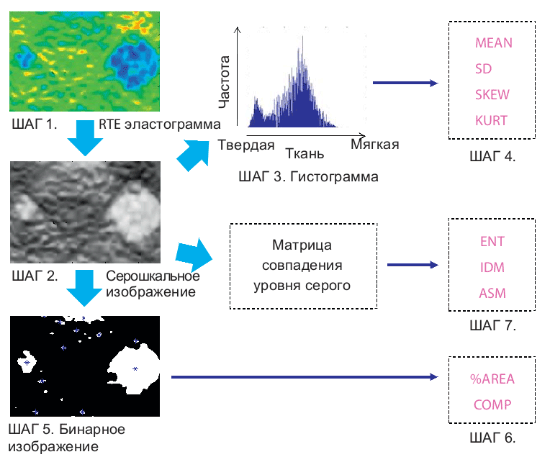
Это программное обеспечение преобразует выбранную область анализа эластограммы RTE (ШАГ 1) в изображение с 256 оттенками серого (ШАГ 2), строит гистограмму деформации (ШАГ 3) и вычисляет среднее значение относительной деформации (MEAN), стандартное отклонение относительной деформации (SD), ассиметрию гистограммы (SKEW) и эксцесс гистограммы (KURT, ШАГ 4). Кроме того, оно преобразует эластограмму RTE в черно-белое бинарное изображение: белые области со слабым сжатием (на эластограмме до преобразования были синего цвета) и черные – все остальные (ШАГ 5). Преобразованное бинарное изображение анализируется для вычисления отношения областей со слабой деформацией (бывшие синие области) к общей площади области анализа (%AREA) и сложность областей со слабой деформацией (COMP, ШАГ 6). Кроме того, программное обеспечение также вычисляет энтропию (ENT), обратный момент разностей (IDM) и второй угловой момент (ASM) для оценки текстуры эластограммы (ШАГ 7). Затем был выполнен множественный регрессионный анализ для повышения точности диагностики с использованием всех этих 9 характеристик изображения вместо диагностики по каждой отдельной характеристики.
Индекс фиброза печени LF Index оценивали, используя эти 9 характеристик эластограммы RTE в качестве независимых переменных, а стадию фиброза печени – как зависимую переменную, как показано в следующем множественном регрессионном уравнении (примечание переводчика: подразумевается анализ с использованием нейронных сетей):
LF Index =
-0,009 x MEAN - 0.005 x SD + 0,023 x %AREA + 0,025 x COMP + 0.775 x SKEW - 0.281 x KURT
+ 2.083 x ENT + 3.042 x IDM + 39,979 x ASM - 5.542.
Был также проведен множественный регрессионный анализ для оценки индекса активности печени (Liver Activity Intex, LA Index, LAI) с использованием этих 9 параметров изображения как независимых переменных и уровня воспалительной активности в качестве зависимой переменной. LF Index и LA Index были рассчитаны для всех пациентов и сравнивались со стадией фиброза печени и уровнем воспалительной активности. Затем, чтобы устранить влияние воспалительной активности на фиброз печени, LA Index и уровень воспалительной активности сравнивали для каждой стадии фиброза печени. Рабочая характеристика приёмника (ROC-кривая) была выполнена для LF Index для получения значений отсечки по идентификации стадий фиброзов F0-1 / F2-4 и F0-3 / F4, а также для вычисления чувствительности, специфичности точности и площадью под ROC-кривой (AUROC).
Статистический анализ.
Весь статистический анализ, такой как множественный регрессионный анализ и анализ ROC-кривых, проводился с использованием программного обеспечения для статистического анализа JMP, версия 8.0 (разработки SAS Institute Inc., Cary, N.C., USA) на базе операционной системы Windows.
РЕЗУЛЬТАТЫ
Пациенты.
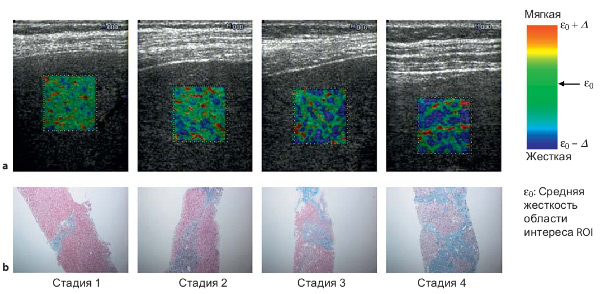
Мы проводили эластографию печени у 365 пациентов (включая 15 здоровых добровольцев) с апреля 2005 года по ноябрь 2009 года. Мы исключили из нашего исследования 55 пациентов, т.к. для этих пациентов невозможно было получить более 3-х устойчивых эластограмм RTE. Большинство причин исключения были связаны с недостаточными навыками операторов, которые впоследствии улучшили их с опытом. Таблица 1 показывает исходные данные 295 пациентов (исключая 15 здоровых добровольцев). Указаны стадии фиброза у пациентов: F0 у 1 пациента, F1 у 84 пациентов, F2 у 97 пациентов, F3 у 65 пациентов и F4 у 48 пациентов. Стадия фиброза у всех здоровых добровольцев была F0. Типичные эластограммы RTE и патологические гистологические изображения для каждой стадии фиброза показаны на Рисунке 2.
Рисунок 2.
Компрессионные эластограммы RTE (a) и
гистологические изображения, окрашивание трихром по Массону, увеличение х100 (b)
Корреляция между характеристиками изображения и стадиями фиброза.
В настоящем исследования, как описано ранее, мы получили 9 характеристик эластографического изображения. Коэффициенты корреляции между 9 характеристиками изобраежния, такими как MEAN, SD,% AREA, COMP, SKEW, KURT, ENT, IDM и ASM и стадиями фиброза печени составляли -0,63, 0,53, 0,65, 0,58, 0,59, 0,02, -0,22, 0,34 и 0,21 соответственно. Таким образом, 5 из 9 характеристик изображения, а именно MEAN, SD,% AREA, COMP и SKEW, сильно коррелирует со стадией фиброза печени (Рисунок 3).
Рисунок 3.
Сравнение стадий фиброза печени с различными вычисленными характеристиками эластографического изображения.
Точность оценки стадий фиброза печени по индексу фиброза печени LF Index .
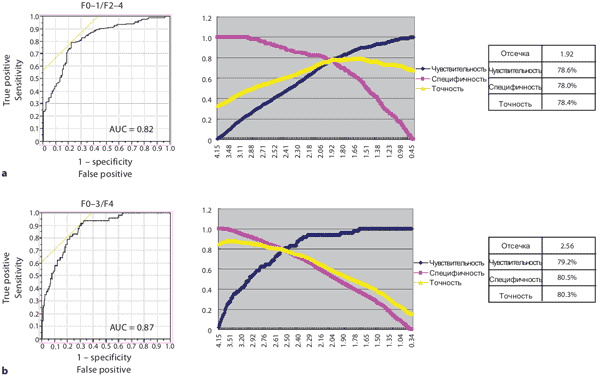
На Рисунке 4 показана взаимосвязь между стадиями фиброза печени и индексом фиброза печени LF Index, полученным на основании 9 рассмотренных характеристик изображения при помощи множественного регрессионного анализа (примечание переводчика: т.е. с использованием нейронных сетей). LF Index сильно коррелирует со стадиями фиброза печени (r = 0.68 при p < 0.001) и существуют значительные различия между всеми стадиями фиброза. Рисунок 5 показывает анализ ROC-кривых. Когда значение отсечки LF Index было установлено как 1.92, значение AUROC LF Index для F0-1 против F2-4 составляло 0.82, а чувствительность, специфичность и точность как 78.6 , 78.0 и 78.5% соответственно (Рисунок 5). В этом исследовании индекс фиброза печени LF Index четко дифференцирует F0-1 и F2-4 или F0-3 и F4.
Рисунок 4. Сравнение стадий фиброза печени и индекса фиброза печени LF Index .
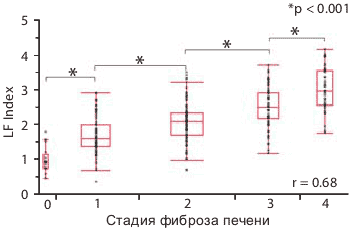
Рисунок 5. ROC анализ различий стадий F 2-4 от F 0-1 (a) и F 4 от F 0-3 (b)
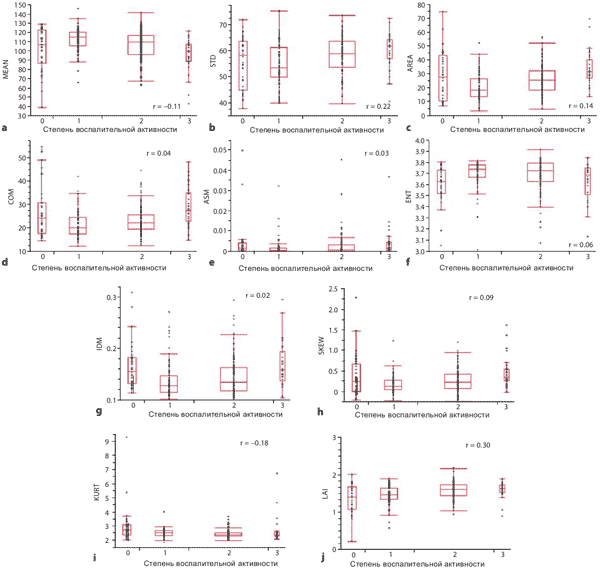
Влияние воспаления
На Рисунке 6 показано сравнение степени воспалительной активности и 9 параметров эластографического изображения для оценки эффекта воспаления на эластограммы RTE. Ни один из 9 параметров изображения не имеет корреляции со степенями воспалительной активности. Индексом активности LA Index, который был рассчитан по множественному регрессионному анализу наподобие LF Index, также не имеет корреляции со степенями воспалительной активности (r = 0.30, Рисунок 6 j ).
Рисунок 6. Сравнение степени воспалительной активности и параметров изображения.
ОБСУЖДЕНИЕ
Результаты оценки.
Чтобы повысить точность оценки фиброза печени и сделать его автоматическим, мы выполнили множественный регрессионный анализ с использованием 9 выделенных характеристик изображения и получили оценку индекса фиброза печени LF Index. Этот индекс сильно коррелирует со стадиями фиброза печени (r = 0.68, p < 0.001), а также наблюдаются значительные различия между каждой стадией. Кроме того, анализ ROC-кривых показал, что LF Index имеет хорошую способность к дифференциации каждой стадии.
Все 9 параметров эластографического изображения, которые мы использовали, являются независимыми и не включают смешивающие факторы. Из 9 параметров изображения, только 5 имели высокую корреляцию со стадиями фиброза печени: % AREA, MEAN, SD, COMP и
SKEW.
Эта сильная корреляция, как мы полагаем, в основном обусловлена следующими причинами:
Оценка гистопатологической ткани с использованием биопсии печени был золотым стандартом для оценки фиброза печени. Однако эта процедура является инвазивной, болезненной и может вызывать осложнения, такие как кровоизлияния, из-за которых пациенты колеблются по поводу применения процедуры биопсии. Кроме того, если количество тромбоцитов невелико, активированное частичное тромбопластиновое время больше 3 секунд, в печени присутствует опухоль и асцит, то биопсию сложно провести. В настоящее время у таких пациентов, где биопсия печени не может быть выполнена, она заменяется анализом крови, имеющим гораздо меньшую точность. Таким образом, наша методика применения индекса фиброза печени LF Index, в основе которого лежит компрессионная эластография RTE, безболезненная, экономичная и может быть выполнена в присутствии любого из вышеуказанных условий. Такая методика является хорошим дополнением для прочим клиническим инструментам для неинвазивной оценки фиброза печени.
Влияние воспаления.
Мы не обнаружили никакого корреляции между любым из 9 параметров изображения и показателями воспаления. Эластографическое изображение RTE, мы считаем, отображает фиброз печени без учета фактора воспаления (внутриклеточное давление и изменение кровотока из-за воспаления). В дополнение, пространственное разрешение эластограмм RTE составляет 0.5-2 мм [43], которые могут полностью визуализировать регенерирующие конкреции при циррозе печени размером 3-10 мм [44]. Таким образом, мы можем заключить, что индекс фиброза печени LF Index, который мы разработали, не зависит от воспаления и зависит главным образом от фиброза печени. По сравнению с компрессионной эластографией RTE, другие методы на основе эластографии сдвиговой волны такие как Fibroscan и ARFI, имеют сильную корреляцию с воспалением [45-47]. Эта корреляция может быть в основном потому, что при анализе сдвиговых волн используется измерение скорости сдвиговой волны. Воспалительные факторы, такие как внутриклеточное давление и состояние кровотока могут изменять скорость сдвиговых волн, что приводит к искажению оценки.
Восприимчивость компрессионной эластографии RTE
Для наших эластограмм и вычисления индекса фиброза печени мы использовали сжатие/релаксацию тканей, вызванную сердечной сократимостью. Это помогло упростить получение изображений RTE и облегчило клиницистам принять эластограммы для анализа. Однако для некоторых пациентов со слабым сердечным сокращением и/или страдающих ожирением, было трудно получить хорошие эластограммы. Обучение клиницистов было необходимо, чтобы избежать артефактов, связанных с ожирением, верно устанавливать область интереса ROI, чтобы не включать сосуды и регулировать положение датчика для захвата печени так, чтобы сжатие и релаксация были однородными и находили в одной плоскости с датчиком. Эластограммы были собраны в трех больницах, два клинициста выполняли эластографию печени. Параметры изображений были извлечены из усредненной эластограммы, полученной из нескольких отдельных эластограмм пациента.
Систематическая ошибка при выборе пациентов
В нашем исследовании мы не включали пациентов, которые с трудом задерживали дыхание или для которых было сложно вывести изображение печени из-за кишечных газов. Более того, мы исключили 55 пациентов, о которых писали выше по причинам, указанным в Таблице 1. Итого было использовано 84,9% пациентов (310/365), что по-прежнему впечатляет, несмотря на эти исключения. Большинство исключений произошло в самом начале исследования. Поскольку со временем клиницисты приобрели опыт, то частота отказов значительно сократилась, а показатель успеха увеличился до 98% (98/100). Это означает, что по мере обучения и тренировки, количество успешных диагностик увеличится.
Мы сравнивали результаты индекса фиброза печени LF Index, полученных на основании компрессионных эластограмм RTE с гистопатологическими результатами биопсии печени. Однако результаты биопсии печени сами по себе имеют предвзятость из-за ошибки выборки и из-за того, что гистопатологические изображения классифицируются не по непрерывному количеству, а по прогрессированию фиброза печени. Кроме того, существуют большие различия в развитии фиброза печени 4 стадии [40], так что биопсия печени имеет ограничения. Поскольку результаты биопсии печени используются как учебный набор (примечание переводчика: учебный набор для тренировки нейронной сети и получения коэффициентов в уравнении индекса фиброза печени) для расчета LF Index, мы предполагаем, что есть также некоторые предвзятости в нашей оценке фиброза печени. Необходим новый индекс в качестве обучающих данных для получения множественного регрессионного уравнения и для уменьшения разброса результатов.
В качестве будущего повышения точности индекса фиброза печени, возможна оценка стадии фиброза печени двумя или более клиницистами с использованием контрольного образца после хирургической резекции. Таким образом, есть основания к повышению точности индекса фиброза печени со временем.
Наши результаты оценки фиброзов печени очень впечатляют. Метод является автоматическим, последовательным и очень хорошо согласуется с результатами биопсии печени. Таким образом, в ближайшем будущем мы ожидаем, что компрессионная эластография RTE может быть использована в качестве инструмента первого выбора для диагностики фиброзов печени. В подозрительных случаях, биопсия может быть проведена для окончательного подтверждения. Кроме того, RTE может быть единственным выбором, доступным вместе с анализом крови для пациентов, у которых биопсия невозможна. RTE также может использоваться для контроля прогрессирования или разрешения фиброза у пациентов, получающих интерферон. Компрессионную эластографию RTE также можно использовать для мониторинга прогрессирования фиброзов у пациентов без лечения интерфероном. Методика RTE проста в использовании, экономична и, более того, безболезненна. Она легко доступна в ультразвуковых аппаратах в качестве дополнительного режима, что делает технику легко доступной и простой в использовании, когда проводится скрининг печения для наблюдения за циррозом и исключения рака печени. RTE также может применяться у пациентов с невирусными гепатитами, такими как неалкогольный стеатогепатит (НАСГ) и т.п.
ЗАКЛЮЧЕНИЕ
Индекс фиброза печени LF Index, вычисленный на основе изображений компрессионной эластографии RTE (FUJIFILM (HITACHI)), сильно коррелирует со стадиями фиброза печени и точно оценивает фиброз даже при наличии воспаления. Таким образом, этот индекс может использоваться для скрининга, мониторинга и диагностика фиброза печени. Мы считаем, что наши результаты и наши методы превосходят другим методы, такие как транзиентная эластография. В ближайшем будущем мы планируем провести более обширные клинические исследования как для обоснования наших результатов, так и для доказательства клинической пользы компрессионной эластографии для оценки фиброзов печени.
БЛАГОДАРНОСТИ
Мы хотели бы поблагодарить Akiko Tonomura, Tsuyoshi Mitake, Mitsuru Motoki, Tomoko Furuta, MD, Chie Tatsumi, MD, Shigeo Wada, MD и Masahide Oshita, MD, за ценные вклад к этому исследованию.
РАСКРЫТИЕ ИНФОРМАЦИИ
Авторы заявляют, что конфликта интересов нет.
СПИСОК ЛИТЕРАТУРЫ
1 WHO International Agency for Research on Cancer: World Cancer Report 2008. Section 1 – global cancer control, chapter 1.3: worldwide cancer burden. http://www.iarc.fr/en/publications/pdfs-online/wcr/2008/index.php.
2 WHO International Agency for Research on Cancer: World Cancer Report 2008. Section 2 – etiology of cancer, chapter 2.5: chronic Infections.
3 Yoshida H, Shiratori Y, Moriyama M, et al: Interferon therapy reduces the risk for hepatocellular carcinoma: national surveillance program of cirrhotic and noncirrhotic patients with chronic hepatitis C in Japan. Ann Intern Med 1999;131:174–181.
4 Shiratori Y, Imazeki F, Moriyama M, et al:Histologic improvement of fibrosis in patients with hepatitis C who have sustained response to interferon therapy. Ann Intern
Med 2000;132:517–524.
5 Desmet VJ, Gerber M, Hoofnagle JH, et al: Classification of chronic hepatitis: diagnosis, grading and staging. Hepatology 1994;19:1513–1520.
6 Ichida F, Tsuji T, Omata M, et al: Classification report: new inuyama classification for histological assessment of chronic hepatitis. Internat Hepatol Comm 1996;6:112–119
7 Ishak K, Baptista A, Bianchi L, et al: Histological grading and staging of chronic hepatitis. J Hepatol 1995;22:696.
8 Bataller R, Brenner DA: Liver fibrosis. J Clin Invest 2005;115:209–218.
9 Pinzani M, Rombouts K, Colagrande S: Fibrosis in chronic liver diseases: diagnosis and management. J Hepatol 2005;42:S22–S26.
10 Dienstag JL: The role of liver biopsy in chronic hepatitis C. Hepatology 2002;36:S152–S160.
11 Gebo KA, Herlong HF, Torbenson MS, et al: Role of liver biopsy in management of chronic hepatitis C: a systemic review. Hepatology 2002;36:161–172.
12 Regev A, Berho M, Jeffers LJ, Milikowski C, et al: Sampling error and intraobserver variation in liver biopsy in patients with chronic HCV infection. Am J Gastroenterol 2002;97:2614–2618.
13 Bedossa P, Dargère D, Paradis V: Sampling variability of liver fibrosis in chronic hepatitis C. Hepatology 2003;38:1449–1457.
14 Omata M: A strategy of the treatment for the viral hepatitis (in Japanese). J Jpn Soc Int Med 2004;93:269–276.
15 Manning DS, Afdhai NH: Diagnosis and quantitation of fibrosis. Gastroenterology, 2008;134:1670–1681.
16 Wai CT, Greenson JK, Fontana RJ, et al: A simple noninvasive index can predict both significant fibrosis and cirrhosis in patients with chronic hepatitis C. Hepatology 2003;38:518–526.
17 Imbert-Bismut F, Ratziu, Pieroni L, Charlotte F, et al: Biochemical markers of liver fibrosis in patients with hepatitis C virus infection: a prospective study. Lancet 2001;357:1069–1075.
18 Forns X, Ampurdanes S, Llovet JM, et al: Indentification of chronic hepatitis C patients without hepatic fibrosis by a simple predictive model. Hepatology 2001;36:986–992.
19 Freeman MP, Vick CW, Taylor KJ, et al: Regenerating nodules in cirrhosis: sonographic appearance with anatomic correlation. AJR Am J Roentgenol 1986;146:533–536.
20 Ishikawa H, Ono M, Goto M, et al: Ultrasonographic findings in patients with liver cirrhosis; relationships between parenchymal, superficial echo patterns, and histological findings (in Japanese). Jpn J Med Ultrason 1990;17:522–529.
21 Fujimoto K, Yamamoto Y, Waki H, et al: Tissue characterization using integrated backscatter in viral chronic liver disease. J Ultrasound Med 1999;18(suppl):472.
22 Kumada T, Toyoda H, Ogawa S, et al: Quantification of fibrosis in hepatitis C using statistics analysis tool of ultrasonics (2nd report). Jpn J Med Ultrasonics 2007;34:S641.
23 Ziol M, Handra-Luca A, Kettaneh A, et al: Noninvasive assessment of liver fibrosis by measurement of stiffness in patients with chronic hepatitis C. Hepatology 2005;41:48–54.
24 Joo I, Choi BI: New Paradigm for management of hepatocellular carcinoma by imaging. Liver Cancer 2012;1:94–109.
25 Sandrin L, Fourquet B, Hasquenoph JM, et al: Transient elastography: a new noninvasive method for assessment of hepatic fibrosis. Ultrasound Med Biol 2003;29:1705–1713.
26 Foucher J, Chanteloup E, Vergniol J, et al: Diagnosis of cirrhosis by transient elastography (FibroScan): a prospective study. Gut 2006;55:403–408.
27 Fraquelli M, Rigamonti C, Casazza G, et al: Reproducibility of transient elastography in the evaluation of liver fibrosis in patients with chronic liver disease. Gut 2007;56:968–973.
28 Kim DY, Kim SU, Park JY, Ahn SH, Song KJ, Han KH: FibroScan based risk estimation of HBV-related HCC occurrence: development and validation of a predictive model. Liver Cancer 2012;1:123.
29 Friedrich-Rust M, Wunder K, Kriener S, et al: Liver fibrosis in viral hepatitis: noninvasive assessment with acoustic radiation force impulse imaging versus transient elastography. Radiology 2009;252:595–604.
30 Shiina T, Nitta N, Ueno E, et al: Real time tissue elasticity imaging using the combined autocorrelation method. J Med Ultrasonics 1999;26:57–66.
31 Shiina T, Nitta N, Ueno E, et al: Real time tissue elasticity imaging using the combined autocorrelation method. J Med Ultrasonics 2002;29:119–128.
32 Joo I, Choi BI: New paradigm for management of hepatocellular carcinoma by imaging. Liver Cancer 2012;1:94–109.
33 Itoh A, Ueno E, Tohno E, et al: Breast disease: clinical application of US elastography for
diagnosis. Radiology 2006;239:341–350.
34 Fukunari N: More accurate and sensitive diagnosis for thyroid tumors with elastography – detection and differential diagnosis of thyroid cancers. MEDIX Suppl. 2007. http://www.FUJIFILM (HITACHI)-medical.co.jp/tech/medix/pdf/supple/sup_05.pdf.
35 Tsutsumi M, Miyagawa T, Matsumura T, et al: Real-time balloon inflation elastography
for prostate cancer detection and initial evaluation of clinic pathologic analysis, AJR Am J Roentgenol 2010;194:W471–W476.
36 Hirooka Y, Itoh A, Kawashima H, et al: Diagnosis of pancreatic disorders using contrast-enhanced endoscopic ultrasonography and endoscopic elastography. Clin Gastroenterol Hepatol 2009;7:S63–S67.
37 Fujimoto K, Wada S, Oshita M, et al: Noninvasive evaluation of hepatic fibrosis in patients with chronic hepatitis C using elastography. MEDIX Suppl. 2007. http://www.FUJIFILM (HITACHI)-medical.co.jp/tech/medix/pdf/supple/sup_07.pdf.
38 Tatsumi C, Kudo M, Ueshima K, et al: Noninvasive evaluation of hepatic fibrosis using serum fibrotic markers, transient elastography (FibroScan), and real-time tissue elastography. Intervirology 2008;1:S27–S33.
39 Tatsumi C, Kudo M, Ueshima K, et al: Noninvasive evaluation of hepatic fibrosis for
type C chronic hepatitis. Intervirology 2010;53:76–81.
40 Fujimoto K, Kato M, Tonomura A, et al: Non-invasive evaluation method of the liver
fibrosis using real-time tissue elastography – usefulness of judgment liver fibrosis stage by Liver Fibrosis Index (LF Index) (in Japanese). Kanzo 2010;51:539–541.
41 Haralick RM, Shanmugan K, Dinstein I: Textural features for image classification. IEEE Trans Syst Man Cybern 1973;3:610–621.
42 Mittal D, Kumara V, et al: Neural network based focal liver lesion diagnosis using ultrasound /images. Comp Med Imaging Graphics 2011;35:315–323.
43 Matsumura T, Shiina T, Oosaka T, et al: Development of real-time tissue elastography
(in Japanese). MEDIX 2004;41:30–35.
44 Hoon L, Kim Y, Lee J: Regenerative nodules in liver cirrhosis: findings at CT during arterial portography and CT hepatic arteriography with histopathologic correlation. Radiology 1999;210:451–458.
45 Arena U, Vizzutti F, Abraldes JG, et al: Reliability of transient elastography for the diagnosis of advanced fibrosis in chronic hepatitis C. Gut 2008;57:1288–1293.
46 Vispo E, Barreiro P, Del Valle J, et al: Overestimation of liver fibrosis staging using
transient elastography in patients with chronic hepatitis C and significant liver inflammation. Antivir Ther 2009;14:187–193.
47 Rifai K, Cornberg J, Mederacke I, et al: Clinical feasibility of liver elastography by acoustic radiation force impulse imaging (ARFI). Dig Liver Dis 2011;43:491–497.
Перевод и копирование материалов выполнен в компаниии ООО "Рус-эксп". Копирование текста без разрешения ООО "Рус-эксп" не допускается.
*Примечание: режим эластографии для аппаратов FUJIFILM / HITACHI / ALOKA является опцией - требуется дополнительное программное обеспечение и/или блоки.
**Примечание: производитель FUJIFILM (HITACHI) вправе изменить технические характеристики и возможности данной опции без уведомления.
Купить аппараты FUJIFILM / HITACHI / ALOKA с поддержкой указанной опции или дооснастить уже имеющиеся аппараты FUJIFILM / HITACHI / ALOKA можно у нас в компании ООО "Рус-эксп", обратившись по телефонам (495) 972-24-18, 972-92-14 или отправив запрос на электронную почту info@rus-exp.com