Инсульт - это клинический синдром, представленный очаговыми или общемозговыми нарушениями, развивающийся внезапно, вследствие острого нарушения мозгового кровообращения. Синонимом инсульта является острое нарушение мозгового кровообращения (ОНМК), однако, обычно, под инсультом понимают такое ОНМК, при котором симптомы сохраняются на срок более 24 часов. В случае если симптомы устраняются до истечения 24 часов, такие состояния называются переходящими нарушениями мозгового кровообращения (ПНМК). Частым видом ПНМК являются транзиторные ишемические атаки (ТИА). ПНМК могут быть вызваны не только ишемией (задержкой кровообращения), но и, например, гипертоническим кризом (острым и значительным повышением артериального давления) [1,2].
В зависимости от причины острого нарушения мозгового кровообращения инсульт подразделяется на ишемический (код 163 по МКБ-10) и геморрагический (код 160 – 162 по МКБ-10) [3]. При ишемическом инсульте происходит уменьшение кровоснабжения тканей головного мозга (часто из-за закупорки сосуда тромбом), вследствие чего наступает снижение функционирования и гибель нейронов. При геморрагическом инсульте происходит разрыв сосудов, питающих ткани головного мозга, вследствие чего наступает кровоизлияние в мозг и, следовательно, сдавление тканей мозга, приводящее к гибели нейронов.
Диагностика инсульта
При появлении у пациента симптомов ОНМК следует провести дифференциальную диагностику ишемического и геморрагического инсульта, так как в острый период лечение этих двух разновидностей инсульта кардинально различается.
Методы инструментальной диагноcтики ОНМК:
Ишемический инсульт
Ишемический инсульт (ИИ) – острое нарушение мозгового кровообращения (ОНМК) по ишемическому типу с образованием стойкого морфологического и неврологического дефекта, сохраняющегося более 24 часов. Хотя инсульт не является наследственным заболеваниям, наследуются многие факторы риска, предрасполагающие к данной патологии.
Факторы риска ишемического инсульта:
Факторы риска подразделяются на модифицируемые (те, на которые мы в состоянии повлиять), например, вредные привычки, артериальная гипертензия и т.д., и немодифицируемые, например, возраст, пол (известно, что у мужчин вероятность инсульта несколько выше, чем у женщин – это связывают с ангиопротекторными свойствами эстрогенов). Практически никогда не встречаются случаи инсульта, при которых нет ни одного из вышеперечисленных предрасполагающих факторов [1,2].
Патогенез ишемического инсульта
В конечном итоге влияние всех факторов риска ИИ можно свести к трем основным вариантам патогенеза ишемического инсульта:
- повышению вероятности тромбообразования
- окклюзии (сжатию) сосудов, кровоснабжающих головной мозг
- увеличению риска острой гипотонии (например, при инфаркте миокарда)
Данные механизмы патогенеза ИИ легли в основу патогенетической классификации ишемического инсульта [1,2,4].
Классификация ишемического инсульта TOAST (Trial of Org 10172 in Acute Stroke Treatment) [5]
При ишемическом инсульте в головном мозге формируется зона ишемии, в которой происходит снижение функционирования и гибель нейронов. Зона ишемии состоит из ядра, где нейроны гибнут в течение нескольких минут после начала ОНМК. Зона ядра, как правило, имеет небольшой размер, и гибель нейронов в ней не имеет большого клинического значения. Вокруг зоны ядра располагается большая по размеру зона ишемической полутени, также называемая пенумбра. Нейроны данной зоны находятся в промежуточном состоянии – они уже не функционируют, но еще не погибли. Окончательная гибель нейронов в этой зоне происходит через 3-6 часов после начала ОНМК. Известно, что причиной большинства ишемических инсультов является закупорка одной из мозговых артерий тромбом. Если в течение нескольких часов после инсульта растворить этот тромб, то может произойти восстановление нейронов в зоне ишемической полутени и, следовательно, устранение большинства симптомов ОНМК. На данном положении основывается единственный эффективный на сегодняшний день способ лечения ишемического инсульта – тромболитическая терапия [6]. В нашей стране она проводится с помощью препарата актилизе (алтеплаза) - рекомбинантного человеческого тканевого активатора плазминогена.
Как уже было отмечено выше, важнейшим методом инструментальной диагностики ОНМК является нейровизуализация. На второе место по диагностической значимости можно с уверенностью поставить ультразвуковую диагностику. Для профилактики ОНМК по ишемическому типу ультразвуковые исследования выходят на первое место. Как мы уже говорили, одной из основных причин ОНМК по ишемическому типу является острый тромбоз сосудов головного мозга. Чаще всего происходит тромбоэмболия. Приведем типичный патогенез ОНМК по ишемическому типу: атеросклеротическая бляшка, постепенно формирующаяся на стенке одного из сосудов, в определенной момент времени теряет стабильность, отрывается, и с током крови переносится в артерии головного мозга, где закупоривает одну из мозговых артерий. Возникает вопрос – можно ли было предупредить развитие данного осложнения. Конечно же, можно. Профилактика инсульта давно известна – отказ от вредных привычек, диета, борьба со стрессами и так далее. Но, увы, известно, что у большинства людей в возрасте старше 50 лет все же наблюдаются атеросклеротические поражения сосудов, и, следовательно, повышается риск тромбоза сосудов головного мозга. Для профилактики данного осложнения необходимо следить за состоянием кровотока в сосудах, питающих головной мозг. На сегодняшний день самым лучшим методом здесь является ультразвуковое исследование. Причем необходима диагностика не только состояния экстракраниальных сосудов, но и интракраниальных, для чего в современной медицине широко применяется транскраниальное сканирование. Чаще всего используется транскраниальное дуплексное сканирование – совместное использование B-режима и импульсного доплеровского режима. Часто данный вид сканирования называют триплексным сканированием, подчеркивая, что используется цветовое допплеровское кодирование потока. Наличие костей черепа на пути ультразвука существенно осложняет данный вид сканирования. Для прохождения костного слоя приходится использовать датчики с низкой частотой, обычно, 2-2,5 МГц. Вследствие этого не удается достичь необходимой разрешающей способности для анализа состояния сосудистой стенки, поэтому информацию о структуре сосудистой стенки врач получает, оценивая сосудистый кровоток с использованием доплеровского режима.
Транскраниальное сканирование
Транскраниальное дуплексное сканирование (ТДС) осуществляют на аппарате, в котором используют комбинацию низкой частоты излучения и импульсной допплеровской методики. Эффективная дальность прибора от 2,5 до 15 см, причем глубину локации можно изменять ступенчато через каждые 0,5 см.
Кровоснабжение головного мозга
Кровоснабжение головного мозга осуществляется из бассейнов двух систем артерий – каротидной и вертебробазилярной. Каротидная система происходит из общей сонной артерии, которая разделяется на внутреннюю и наружную сонные артерии. Внутренняя сонная артерия разделяется на переднюю и среднюю мозговые артерии. Вертебробазилярная система происходит из позвоночной артерии, переходящей в базилярную артерию, разделяющуюся на правую и левую задние мозговые артерии. Средняя мозговая артерия является самой крупной артерией, кровоснабжающей головной мозг [7]. В 80% случаев инсульты наблюдаются в бассейне средней мозговой артерии. В основании головного мозга артерии замыкаются в Виллизиев круг, который является полностью замкнутым у 20-50% людей. Замкнутый Виллизиев круг является хорошим прогностическим признаком при ОНМК, так как он может обеспечить нормальное кровоснабжение тканей мозга при закупоривании одного из сосудов (Рис.1).
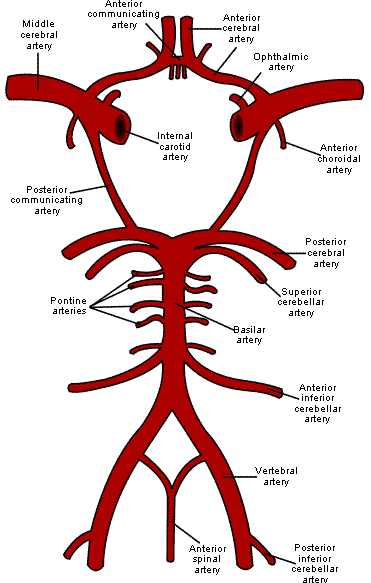
Рисунок 1. Кровоснабжение головного мозга.
Методика транскраниального сканирования
Для локации передней, средней и задней мозговых артерий служит «УЗ-окно» в височной области выше скуловой дуги между латеральным углом глазницы и ушной раковиной. Локацию средней мозговой артерии проводят при фокусировании УЗ-луча на глубине 45-50 мм, а передней и задней мозговых артерий – на глубине 60-70 мм. Точную идентификацию сосуда выполняют с помощью специальных компрессионных проб.
В результате можно определить среднюю и объемную скорость кровотока, спектрограмму и ее составляющие. Величина кровотока (см/с) по передней мозговой артерии составляет 50±11; по средней – 62±12; по задней – 39±10.
Рисунок 2. Транскраниальная доплерография.
Транскраниальное дуплексное сканирование проводится неинвазивно, векторным (секторным) датчиком, генерирующим импульсные колебания с частотой 1-2,5 МГц (2 МГц) через определенные доступы (окна) на поверхности головы, обеспечивающие минимальную толщину костной ткани. По одной из методик основными доступами являются транстемпоральный - через чешую височной кости, и субокципитальный - через большое затылочное отверстие, дополнительными - трансорбитальный - через верхнюю глазничную щель и трансокципитальный - через чешую затылочной кости, над затылочным бугром [8].
По другой методике дуплексное сканирование проводится через транстемпоральное, трансорбитальное и и трансфораминальные окна. При этом трансфораминальное окно находится в верхней части шеи, ниже затылочной кости, и используется для визуализации основной артерии и внутричерепных отделов позвоночной артерии (Рис.3) [9].
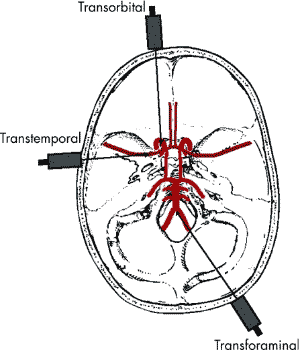
Рисунок 3. Трансорбитальное, трансфораминальное и транстемпоральное окно для дуплексного сканирования.
На рисунке 4 приведено изображение еще одной схемы доступов для дуплексного транскраниального сканирования. Как мы видим, все методики транскраниального сканирования используют практически одни и те же окна.
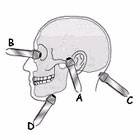
Рисунок 4. Позиция датчика для четырех транскраниальных окон. (A) транстемпоральное, (B) трансорбитальное, (C) субокципитальное, (D) субмандибулярное [10].
Список мозговых артерий, визуализируемых в каждом транскраниальном доступе, а также глубины их расположения и средние скорости кровотока, представлены в таблице 1.
Таблица 1. Список мозговых артерий, визуализируемых в каждом транскраниальном доступе, а также глубины их расположения и средние скорости кровотка [11]:
Окно |
Артерия |
Глубина (мм) |
Значения скорости (см/c) |
| Транстемпоральное | Средняя мозговая MCA | 30 - 67 |
62 +/- 12 |
| Передняя мозговая ACA | 60 - 80 |
50 +/- 11 |
|
| Внутренняя сонная (терминальная) ICA | 60 - 67 |
39 +/- 9 |
|
| Задняя мозговая PCA | 55 - 80 |
39 +/- 10 |
|
| Задняя соединительная PCoA | |||
| Передняя соединительная ACoA | |||
| Трансорбитальное | Офтальмическая OA | 40 - 60 |
21 +/- 5 |
| Внутренняя сонная (сифон) ICA | 60 - 80 |
47 +/- 10 |
|
| Субокципитальное | Позвоночная VA | 40 - 85 |
38 +/- 10 |
| Базилярная BA | >80 |
41 +/- 10 |
|
| Субмандибулярное | Внутренняя сонная (дистальная) ICA | 35 - 70 |
37 +/- 9 |
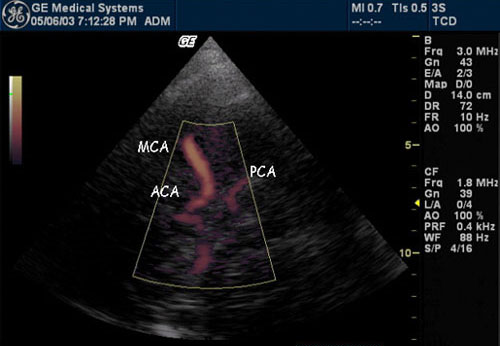
Рисунок 5. Визуализация Виллизиева круга, проведенная из транстемпорального окна.
ACA – передняя мозговая артерия, MCA – средняя мозговая артерия, PCA – задняя мозговая артерия [11].
При проведении транскраниального дуплексного сканирования достаточно информативным является анализ допплеровского спектра, позволяющий оценить состояние транскраниальных и экстракраниальных сосудов. На рисунке 6 приведен допплеровский спектр дуплексного транскраниального сканирования пациента с экстракраниальным стенозом внутренней сонной артерии.
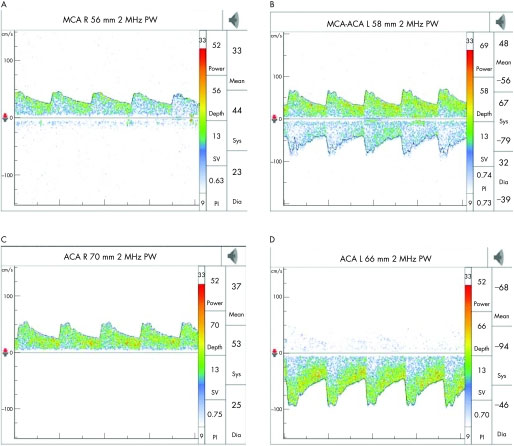
Рисунок 6. Эффект экстракраниального стеноза внутренней сонной артерии (ВСА) на церебральную гемодинамику (пациент имел высокую степень стеноза проксимальной правой ВСА). (А) Уменьшение скорости потока в правой (ипсилатеральной) средней мозговой артерии (СМА). (B) Нормальная скорость потока в левой (контрлатеральной) СМА и увеличенная скорость потока в левой (контрлатеральной) передней мозговой артерии (ПМА), вследствие коллатерального кровотока. (C) Реверсия потока в правой (ипсилатеральной) ПМА. (D) Увеличенная скорость потока в левой (контрлатеральной) ПМА [9].
Как упоминалось выше, замкнутый Виллизиев круг является хорошим прогностическим критерием при тромботических поражениях сосудов головного мозга, так как он обеспечивает коллетаризацию кровотока и позволяет сохранить устойчивое кровоснабжение отделов головного мозга. Для получения информации о наличии и функциональной состоятельности конкретных аретрий Виллизиева круга используют компрессионные пробы. При кратковременном пережатии определенных участков сонной артерии, с помощью дуплексного транскраниального сканирования можно зафиксировать усиление кровотока в определенных артериях Виллизиева круга, при условии их наличия и функциональной состоятельности. На рисунке 7 показано определение функциональной состоятельности передней соединительной артерии с применением компрессионной пробы [8].
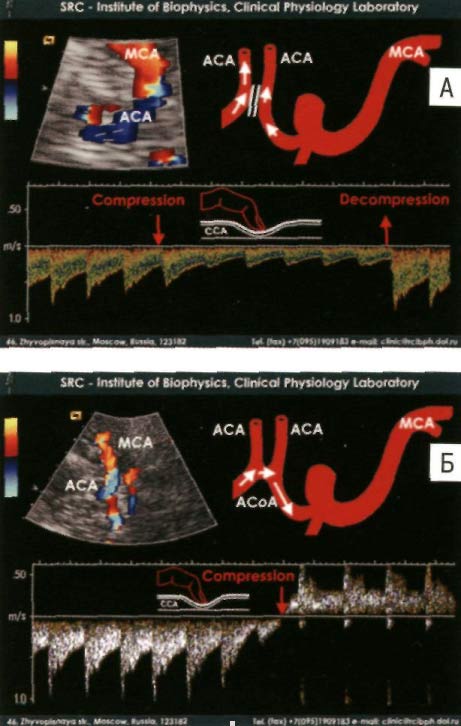
Рисунок 7. Определение функциональной состоятельности передней соединительной артерии с применением компрессионной пробы (компрессия гомолатеральной общей сонной артерии). А. Передняя соединительная артерия отсутствует , или функционально несостоятельна. Б. Передняя соединительная артерия функционально состоятельна [8].
Примечание: ACA – передняя мозговая артерия. MCA – средняя мозговая артерия. ACoA – передняя соединительная артерия.
Заключение
Острое нарушение мозгового кровообращения, в частности, по ишемическому типу, является на сегодняшний день чрезвычайно распространенной патологией. В большинстве случаев причиной ОНМК является тромбоз сосудов головного мозга. Транскраниальное дуплексное сканирование является одним из важнейших методов диагностики состояния сосудов головного мозга, необходимым для профилактики и выявления этиологии нарушений мозгового кровообращения. Суть ТДС состоит в совместном использовании B-режима и импульсного доплеровского режима. Наличие костей черепа на пути ультразвука существенно осложняет данный вид сканирования. На ультразвуковом аппарате при ТДС используют комбинацию низкой частоты излучения, для прохождения сквозь костный слой, и импульсной допплеровской методики, для визуализации кровотока.
Список литературы
1. Кистлер Дж. Ф., Роппер А. Х., Мартин Дж. Б. "Сосудистые заболевания головного мозга. Внутренние болезни", т. 10: 44-107. М., Медицина, 1997.
2. Н.В. Верещагин, М.А. Пирадов, З.А. Суслина, 2001. "Принципы диагностики и лечения больных в остром периоде инсульта" // Consilium Medicum, 2001, т. 3, № 5, с. 221-225
3. Всемирная организация здравоохранения - классификация заболеваний мозгового кровообращения.
4. Гусев Е. И., Скворцова В. И., Чекнева Н. С. и др. "Лечение острого мозгового инсульта (диагностические и терапевтические алгоритмы)". Учебно-методическая литература. М., 1997.
5.
Harold P. Adams Jr., Birgitte H. Bendixen, L. Jaap Kappelle, Jose Biller, Betsy B. Love, David Lee Gordon, E. Eugene Marsh III, and the TOAST Investigators. Classification of Subtype of Acute Ischemic Stroke. Definitions for Use in a Multicenter Clinical Trial. Stroke. 1993, 24: 35-41.
6.
Bogousslavsky J. The global stroke initiative, setting the context with the International
Stroke Society. J Neurol Sciences. 2005, V.238, Suppl.1. IS.166.
7.
Сапин М.Р. Никитюк Д.Б. "Атлас анатомии человека". М., 2001.
8.
Лелюк В.Г., Лелюк С.Э. "Ультразвуковая ангиология". М., 2003.
9.
Sarkar S., Ghosh S., Ghosh S., Collier A. Role of transcranial Doppler ultrasonography in stroke. Postgrad Med J. 2007, November, 83(985): 683–689.
10.
Katz ML. Intracranial Cerebrovascular Evaluation. Textbook of Diagnostic Ultrasonography. Mosby, St. Louis, 2001.
11.
Mira L. Katz. Transcranial Color Doppler Imaging (TCDI). Online CME Courses.